概要
-
自治医科大学では、iPS細胞研究から実用化につながる研究を推進するために、平成25年4月、先端医療技術開発センター内に幹細胞・創薬基盤研究部門を開設しました。
ブタを利用した研究が特徴的です。本部門にユニークな設備は、ブタ用のセルプロセッシングルームです。
ここで加工された細胞が、パスボックスを通して、ブタ手術室に渡され、ブタへの移植実験に供されます。
本施設は、慶應大学グループなど学外研究者にもご利用いただいています。
2020年に部門名がトランスレーショナルリサーチラボラトリーに改称されました。
スタッフ

教授(兼) 花園 豊
Yutaka Hanazono, MD., PhD
1992年、東京大学大学院修了。医学博士。東京大学医学部第3内科助手、アメリカ国立衛生研究所(NIH)客員研究員などを経て自治医科大学教授。専門は、血液内科学・再生医学・幹細胞生物学。 iPS細胞など幹細胞の臨床応用を目指して、サル・ブタ・ヒツジを用いてマウスからヒトへの橋渡し研究を進めている。 2015年4月より、自治医科大学先端医療技術開発センター センター長。2018年7月より自治医科大学オープイノベーションセンター副センター長。「研究は体力が勝負。毎日泳いでます。」

准教授(兼) 魚崎 英毅
Hideki Uosaki, MD., PhD
2011年、医学博士(京都大学)。ジョンズ・ホプキンス大学博士研究員を経て、2016年に自治医科大学再生医学研究部講師として着任。2017年4月より当研究室兼務。12月准教授昇進。
専門は、幹細胞生物学、再生医学。心臓発生、心筋細胞の分化・成熟メカニズムの解明を目指した研究に取り組む。
ちびっこギャングに振り回される日々を堪能中。
研究紹介
-
iPS細胞を利用する再生医療や新しいゲノム編集技術(CRISPR /Cas9)を用いたゲノム治療に関して魅力あふれるさまざまなアイデアがマウス実験などに基づいて提案されていますが、すぐヒトに応用できるわけではありません。
ヒトに応用する前には、サルやヒツジやブタなど大型動物でその有効性や安全性の検証が必要です。
今までに私たちは、日本で初めてサルの骨髄移植を、世界で初めてサルES細胞をサルへ移植する実験を実施しました。
また、サルの心筋梗塞を作製して幹細胞治療のモデル実験を行ってきました。
特に力を入れている研究テーマは (1) 造血幹細胞の動物工場での生産、(2) ゲノム編集技術の医療応用に向けた研究、(3)心筋細胞の成熟の3つです。
大動物を用いた医学研究

我々はマウスのみならず、様々な大型動物を用いた医学研究を行ってきた。この研究室のロゴはそんな我々の研究を体現したものである。
花園教授はNIHへの留学中よりサルを実験動物として用いてきた。自治医大着任後もサルを用いた研究を継続し、造血幹細胞移植や遺伝子治療の研究を行った(Hanazono, Stem Cells, 2001; Gene Ther, 2002など)。現在では、これまでの蓄積を元に、大型動物を用いて新しい治療法の有効性と安全性の検証を進めています。
その後、宇都宮大学長尾教授との共同研究を開始し、ヒツジの胎児肝臓へ造血幹細胞を移植し、ヒツジを造血工場とする新しい手法を確立した(Sasaki, Transplantation, 2005)。最近ではこの手法をヒトiPS細胞へと応用している(Exp Hematol, 2021)。
明治大学長嶋比呂志教授との共同研究では、X-SCIDピッグを作出し(Watanabe, PLoS One, 2013)、免疫不全ピッグを用いた再生医療(細胞移植治療)の基盤を構築した。最近では、X-SCIDピッグをモデルとしたゲノム編集治療法の開発へと展開している(下記2)
2. ゲノム編集技術の医療応用に向けた研究
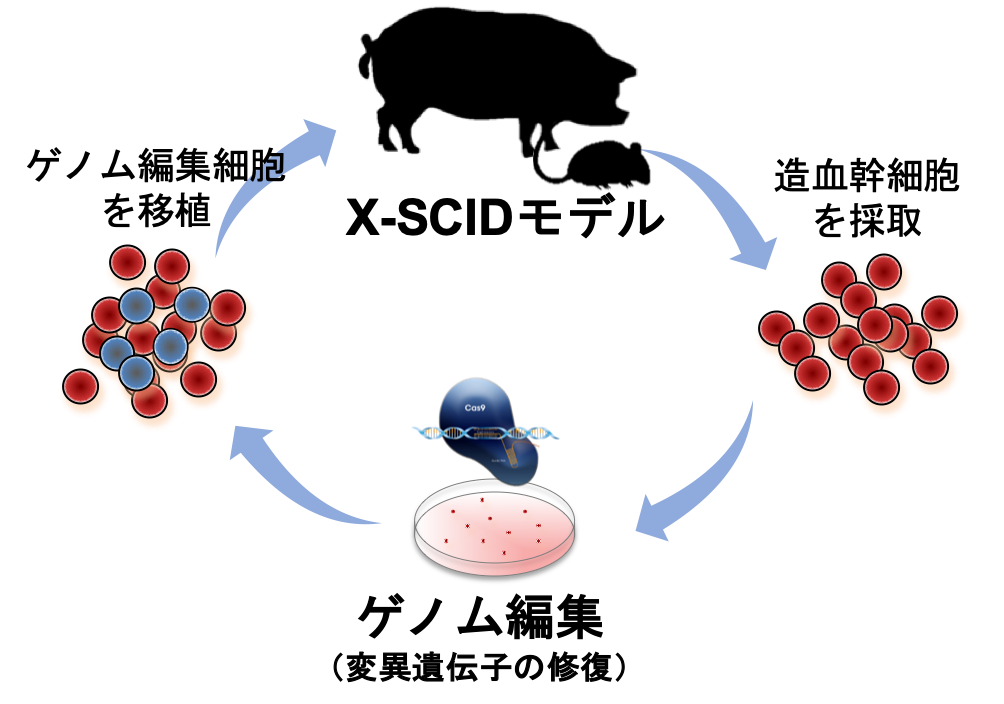
我々はゲノム編集技術(CRISPR-Cas9)を利用する新規治療法の開発を目指している。
原助教とポストドクターのSuvd Byambaa氏を中心として、X染色体連鎖重症複合免疫不全症(X-SCID)のマウスモデルとピッグモデルのゲノム修復治療を目指している。
本研究の中でX-SCIDピッグの無菌的な娩出・飼育を行い,X-SCIDピッグの3ヶ月にわたる飼育に成功し(Hara et al., Exp Anim, 2017)、現在ではさらにその長期化を進めている。
本学 病態生化学部門 大森司教授、東京大学 濡木 理教授、明治大学農学部長嶋比呂志教授などとの共同研究である。
2014-2018年度: AMED 革新的バイオ医薬品創出基盤技術開発事業(研究代表 東京大学 濡木 理)、2018年度-: AMED 遺伝子・細胞治療研究開発基盤事業 (研究代表 本学 免疫遺伝子細胞治療学(タカラバイオ)講座 小澤 敬也 客員教授)、科研費等を受けて研究を進めている。 なお、平成30年度、小澤客員教授が学内に遺伝子治療研究センター(CGTR)を設立し(センター長・山形教授)、花園教授はそのメンバーの一人となった。
3. ヒツジを利用するiPS細胞技術の開発

ヒトiPS細胞から造血幹細胞を安定的に産生することは現時点で困難である。
我々は阿部講師を中心として、この課題に長年取り組んできた。これまでに、臍帯血造血幹細胞をヒツジの胎児に移植することで、長期間ヒツジの体内で生着することを報告している(Abe, Exp Hematol 2011; Exp Hematol, 2012; Exp Anim, 2014)。
同様に、ヒツジの体内を造血工場とすることでヒトiPS細胞由来の造血幹細胞の産生が可能であることを見出している。
更なる効率化により安定的に産生することが可能になれば、動物は、ヒト成体・ヒト臍帯血に次ぐ、造血幹細胞の第三のソースになり、現在のドナー不足の解決につながるでしょう。
宇都宮大学長尾慶和教授との共同研究である。
本研究は、AMED 再生医療実現拠点ネットワークプログラム個別課題「ブタ等大型動物を利用するiPS細胞技術の開発」(代表:花園豊)や科研費 基盤C(代表:阿部朋行)の一環として行っている。
4. ブタ腸内細菌叢のヒト化
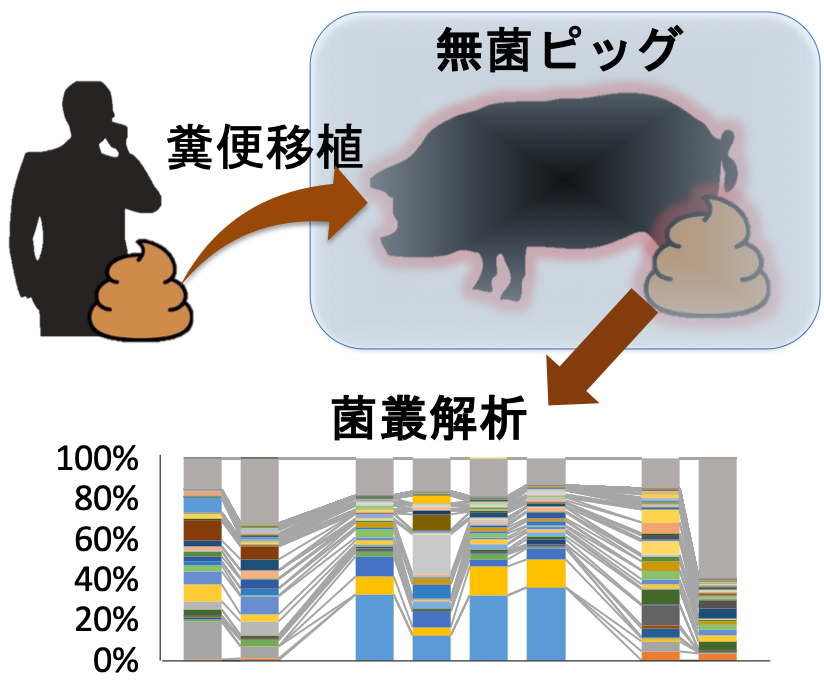
ブタは,食性や消化管の解剖生理学的な特徴がヒトに類似していることから,腸内細菌叢研究においても新たなモデル動物になると期待されている。
X-SCIDピッグの研究を通じて、無菌ブタの作出・維持が可能となった。そこで、無菌ブタにヒトの糞便を経口投与したヒト腸内細菌が腸内に定着したブタを作出した。
現在では、ブタの腸内細菌叢の糞便移植後に見られる経時的な変化、食事の影響に関する研究を行っている。
消化器内科学部門山本博徳教授および慶應義塾大学医学部本田賢也教授との共同研究。
5. 心筋細胞の成熟メカニズムの解明
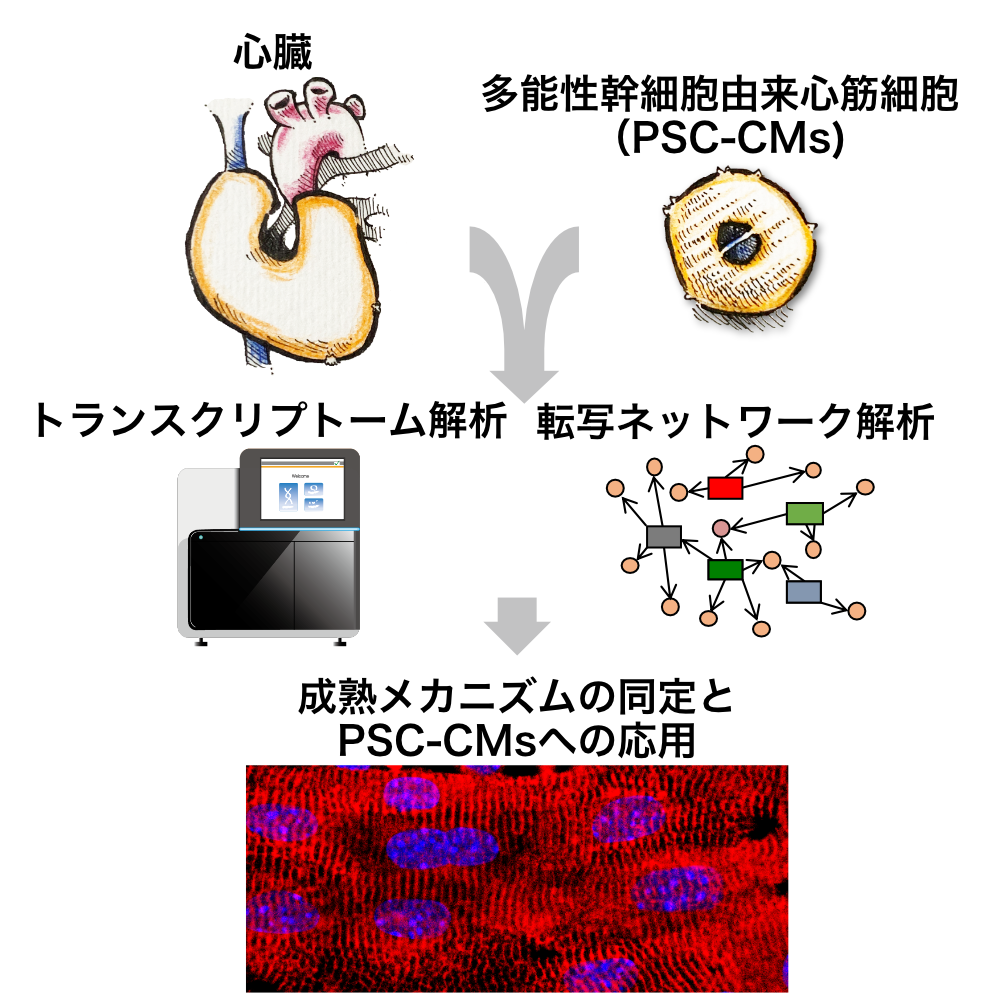
心筋細胞の成熟メカニズム解明に向けて,多面的に研究に取り組んでいる。ES細胞やiPS細胞から分化誘導した心筋細胞は試験管内で成熟しない。これに対してBioinformaticsを用いて推定を行った、成熟刺激を加えることで成熟を促進できることがわかってきている。
本研究により将来的にはヒトiPS細胞などから成熟した心筋細胞を作り出し,心疾患を試験管内で再現することを目指している。
東京大学 谷内江 望准教授、Johns Hopkins大学Chulan Kwon准教授らとの共同研究である。
2016-2018年度はAMED再生医療実現拠点ネットワークプログラム[幹細胞・再生医学イノベーションプログラム]の支援を、2019年度からは科研費若手研究、国際共同研究加速基金[国際共同研究強化B]の補助を受けている。また、複数の民間助成金を受けて研究を進めている。
6. 心疾患モデリング
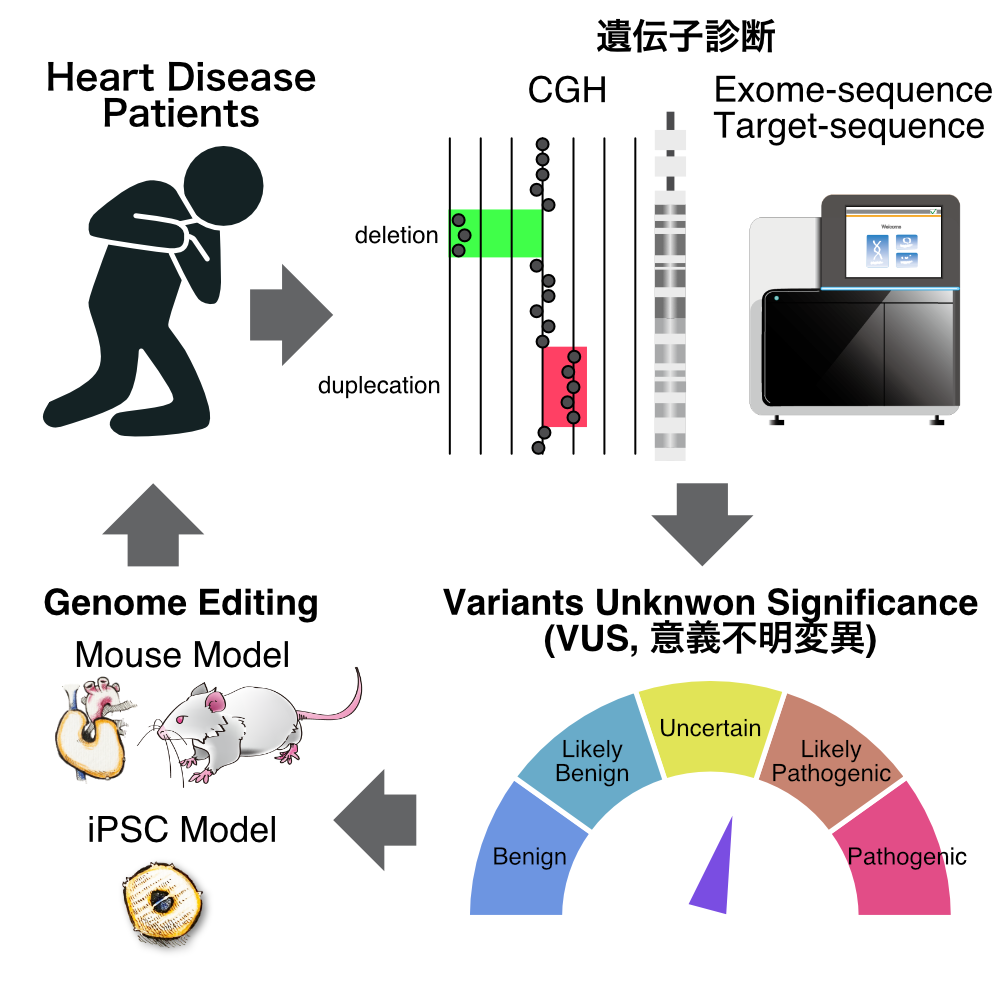
ゲノム編集技術の進歩により、これまでは困難であった遺伝子改変動物が容易に作出できるようになった。これまでに再生医学研究部ではSCIDブタやSCIDマウスを作出してきた。
魚崎グループでは、特に循環器領域での様々な遺伝性疾患を持つモデル動物(マウス、ラット、ブタ)の作出を進めている。特にVariant Unknown Significance(VUS)を中心とした解析を行っている。
また、動物モデルのみならず、iPS細胞を用いた疾患モデリングについても力を入れている。患者由来iPS細胞の樹立とその解析だけでなく、疾患遺伝子を健常iPS細胞由来心筋細胞へと導入する解析など新しい手法開発も進めている。
動物モデルについては群馬大学循環器内科 小板橋 紀通講師、Max Planck Florida Institute for Neuroscience 西園 啓文先生、本学小児科 関 満講師、実験医学センター 長尾恭光准教授、先端医療技術開発センター 本多 新教授、谷原 史倫准教授らとの共同研究で進めている。
一方、iPS細胞を使った研究では、千葉県こども病院村山 圭部長、本学小児科 山形 崇倫教授、小坂 仁教授、村松 一洋准教授、関 満講師、小島 華林講師、先端医療技術開発センター 阿部 朋之講師らとの共同研究で進めている。
私立大学戦略的研究基盤形成支援事業「マウスからヒトへ:大型動物を利用する橋渡し研究」(2013-2018年度)、自治医科大学研究奨励(2017年度)、その他の民間助成金を受けた研究の一環として行っている。 2020年度よりAMED再生医療実現拠点ネットワークプログラム[疾患特異的iPS細胞の利活用促進・難病研究加速プログラム]の支援を受け、ミトコンドリア心筋症のiPS細胞樹立と、ミトコンドリア心筋症iPS細胞由来心筋細胞の表現型解析を進めている。






