研究内容
ヘモグロビンの協同作用の研究
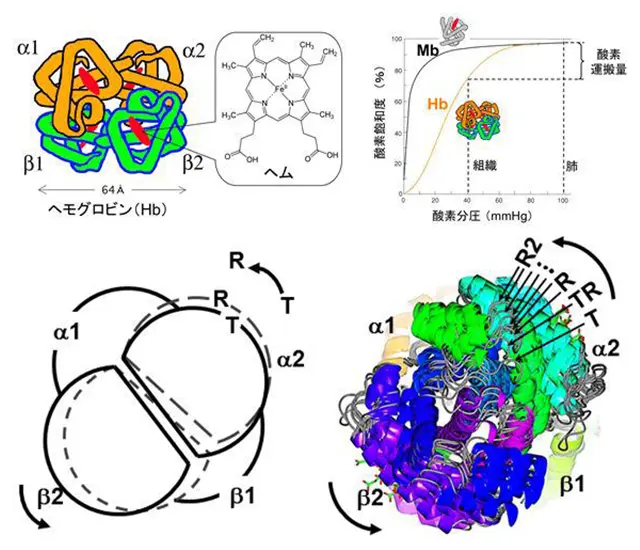
ヘモグロビン(Hb)は、赤血球中にあって肺から末梢組織への酸素運搬を担うタンパク質です。Hbの4個のヘムに4個の酸素が結合する時、はじめの方に結合する酸素が後から結合する酸素を100倍以上も付きやすくする協同作用があります。このおかげで、高効率な酸素輸送が実現されます。私達の研究目標は、協同作用のメカニズムをHbの分子構造のうえから深く理解することです。
Hbの協同作用(上右)の源は、教科書的なTとRの2状態転移(下左)ではなく、多状態間の複雑な分子過程であることを解明(下右)しました。
Hbの協同作用(上右)の源は、教科書的なTとRの2状態転移(下左)ではなく、多状態間の複雑な分子過程であることを解明(下右)しました。
疾患関連タンパク質の立体構造解析
私たちの研究室では、ヘモグロビン研究で培ったノウハウを活かし、学内外の他研究室から提供を受けた疾患関連タンパク質の構造解析を進めています。
例えば、抗インフルエンザ薬の創薬の出発点となるインフルエンザウイルスRNAポリメラーゼのX線結晶構造解析(右上:インフルエンザウイルスRNAポリメラーゼのサブユニット間接触(赤と青)のX線構造)[Nature 454 (2008) 1127-1131.]、腫瘍抑制作用が確認されているプロテアソーム阻害剤とタンパク質との複合体の構造解析(左下:阻害剤K-7174(緑)の結合したプロテアソームのX線構造) [PLoS ONE 8 (2013) e60649.]、などを行いました。
疾患関連タンパク質の構造解析は、疾患発生の分子メカニズムの理解および分子標的薬の開発に重要な意味があり、医学に直接貢献できる研究課題です。
例えば、抗インフルエンザ薬の創薬の出発点となるインフルエンザウイルスRNAポリメラーゼのX線結晶構造解析(右上:インフルエンザウイルスRNAポリメラーゼのサブユニット間接触(赤と青)のX線構造)[Nature 454 (2008) 1127-1131.]、腫瘍抑制作用が確認されているプロテアソーム阻害剤とタンパク質との複合体の構造解析(左下:阻害剤K-7174(緑)の結合したプロテアソームのX線構造) [PLoS ONE 8 (2013) e60649.]、などを行いました。
疾患関連タンパク質の構造解析は、疾患発生の分子メカニズムの理解および分子標的薬の開発に重要な意味があり、医学に直接貢献できる研究課題です。
動的X線結晶構造解析
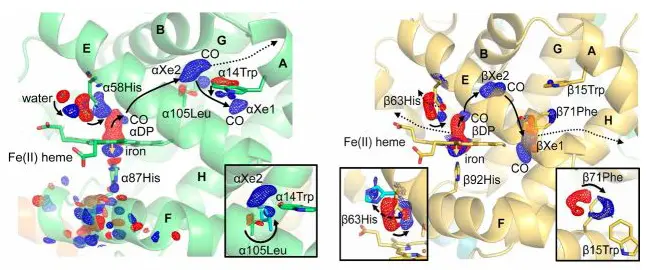
従来のX線結晶解析で得られる静的構造からでは、タンパク質分子の働く最中の「動き」は分かりません。私達は、放射光を利用した動的X線結晶構造解析法の開発に取り組んでいます。従来の「静止画像」から「ムービー」への転換です。
この測定方法は新学術領域研究「ソフトクリスタル」の研究手法にも使われています。
この測定方法は新学術領域研究「ソフトクリスタル」の研究手法にも使われています。
図:CO脱着に伴うヘモグロビン構成原子の動きの直接観察。赤から青へ動く。
原子分解能蛍光X線ホログラフィー
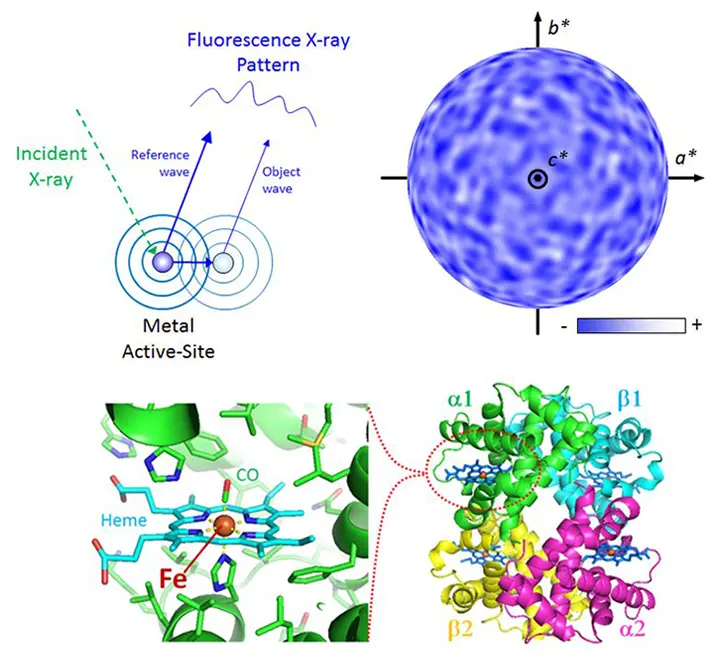
従来のX線結晶構造解析は、モデル依存型の試行錯誤的な過程が必要で、解析に熟練を要しますが、蛍光X線ホログラフィーはその過程が不要となる画期的な原子イメージング法です。タンパク質を対象としたホログラフィーは世界初の試みです。
こちらは新学術領域研究「3D活性サイト科学」の研究テーマのひとつです。
こちらは新学術領域研究「3D活性サイト科学」の研究テーマのひとつです。
右上:Hbの蛍光X線ホログラム(Fe周辺原子の干渉パターン)
左上:蛍光X線ホログラムの発生原理
下:Hbの活性サイト中心
アミロイドーシスおよび神経変性疾患関連タンパク質の研究
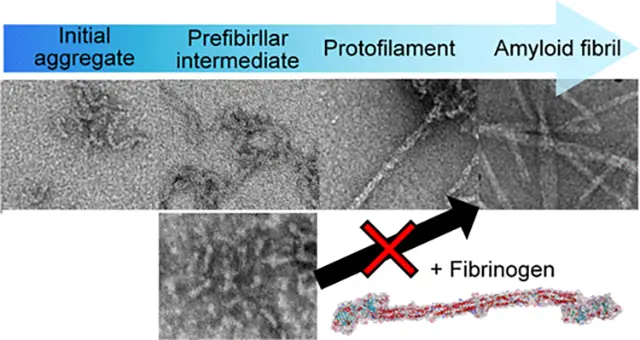
普段は正常な折り畳みをしているタンパク質はアミロイド線維という線維状の異常凝集体を形成し、アルツハイマー病(Aβペプチド)や家族性アミロイドーシス(トランスサイレチン)など様々な疾患に関与していることが知られています。特に、アミロイド線維形成途中段階に出現する中間体とアミロイド線維形成の関係性を明らかにする研究を行っています。そのために、中間体がアミロイド線維になる機序を様々な手法を様々な手法を用いて詳細に調べています[Sci. Rep. 2018, J. Phys. Chem. B 2022]。また、中間体と相互作用してアミロイド線維化を阻害する物質の開拓も行っています [Biochemistry 2019]。
タンパク質と水和水の動きの協同性に関する研究
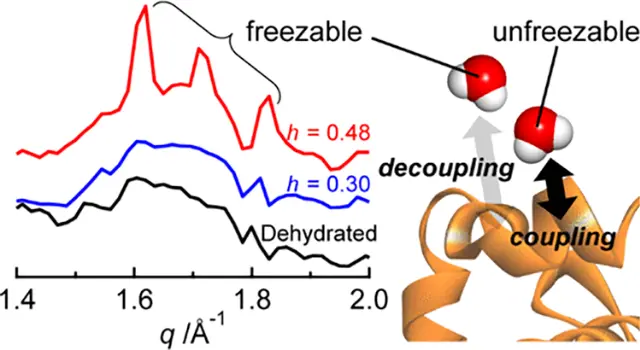
タンパク質周辺に存在する水分子は水和水と呼ばれ、タンパク質と共に動きながらその機能をアシストしていると考えられています。従ってタンパク質と水和水が協同的に動く仕組みを明らかにすることは、タンパク質が機能する際に動く仕組みを理解するうえで重要です。誘電分光やテラヘルツ分光[J. Phys. Chem. B 2016, J. Phys. Chem. B 2018]、また中性子散乱[J. Phys. Chem. Lett. 2021](図)といった手法を駆使してアプローチしています。