佐藤 文菜 Ayana SATO-TOMITA

【研究分野】
- ヘモグロビンの構造学的基礎研究
- X線結晶構造解析などの計測法を用いた色々
研究内容
アロステリック酵素の代表であるヘモグロビンの構造学的基礎研究
ヘモグロビン(Hb)は、赤血球中に存在し、肺から末梢組織への酸素運搬を担うタンパク質です。Hbの4個のヘムに4個の酸素が結合する時、はじめの方に結合する酸素が、後から結合する酸素を100倍以上も付きやすくするという協同作用があります。このおかげで、高効率な酸素の輸送が実現されています。
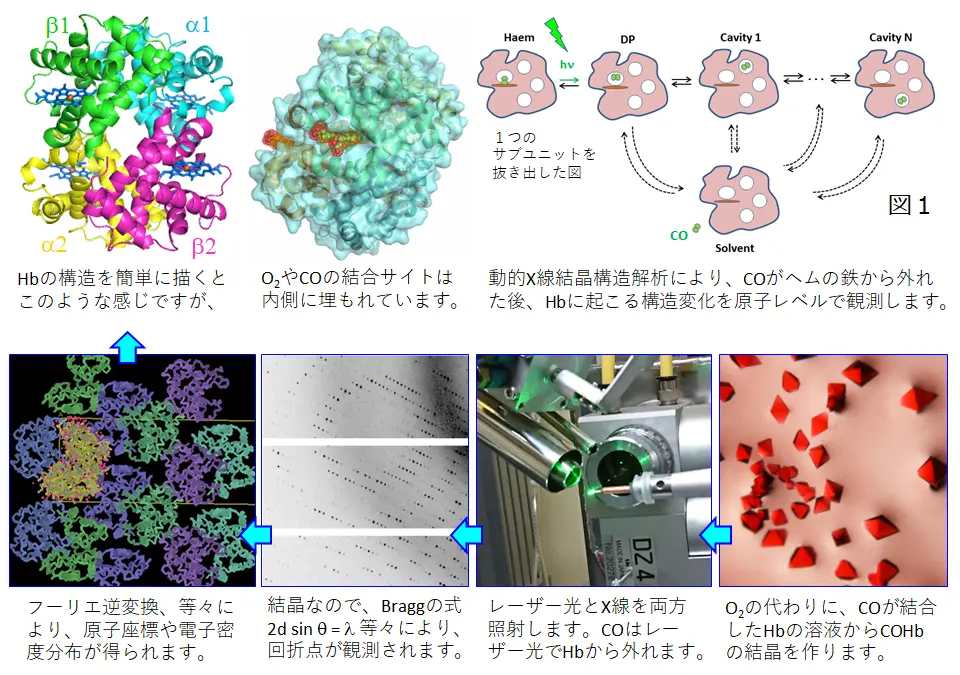
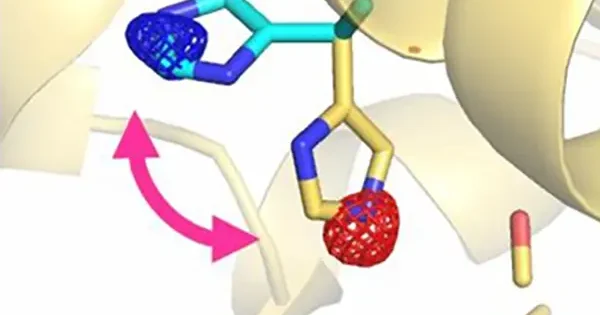
酸素(O2)の代わりに一酸化炭素(CO)を結合させたHbを使って、COが外れる際のHbの構造変化の最初の段階を観測することが出来ました(Shibayama et al., PNAS 117, 4741-4748, 2020、研究領域:動的X線結晶構造解析)。COを使うことで、レーザー光の照射によりHbとCOとの結合を切断することができます。といっても、COは一旦Hbから外れた後、すぐにHbに再結合してしまうので、色々と工夫が必要でした。
私達の研究目標は、協同作用のメカニズムをHbの分子構造のうえから深く理解することです。この研究はここで終わりではなく、今後は分子の高次構造の切り替わりがどこでどのように起こるのかを明らかにしていきたいです。我々の研究室には、構造解析のノウハウだけでなく、Hbに特化した機能測定の装置や、Hbの状態を固定する技術があり、それらを駆使して研究を行うことが可能です。
X線回折法などを用いた機能性分子の構造および働きに関する研究
Hbだけでなく、他のタンパク質や、タンパク質以外のX線結晶構造解析などの共同研究も行っています。
東京薬科大などの皆様との共同研究です。
北大の皆様との共同研究です。
Morimoto et al., Chem. Euro. J. 29, e202301993, 2023
論文誌のフロントカバーに採用されました(図2-3)。 水の有無で発光色が変化する錯体の様子が描かれています。さらに、水と共にある時は2分子がペアになっていることも表現されています。こちらは新学術領域研究「ソフトクリスタル」の研究テーマのひとつで、北大などの皆様との共同研究です。

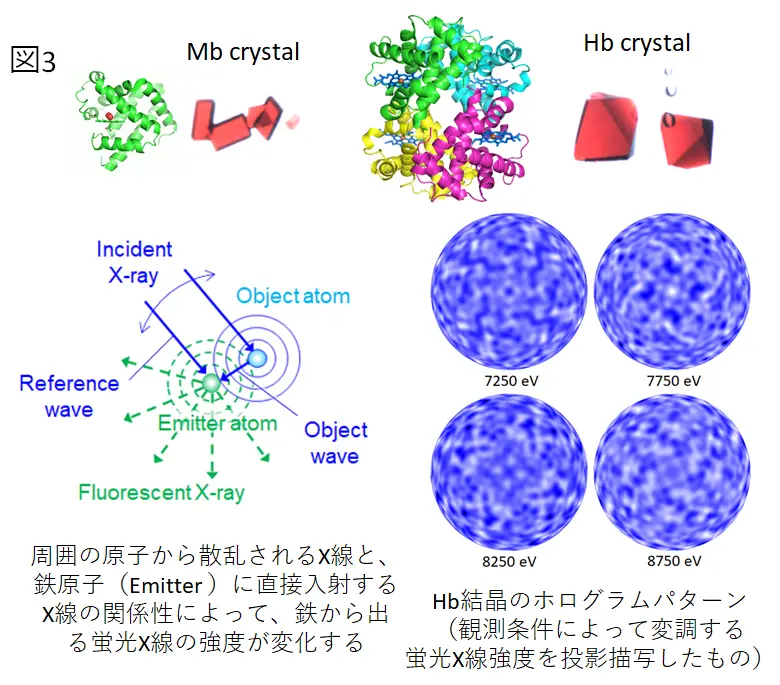
また、タンパク質の水素原子と呼ばれるミオグロビンや、アロステリック酵素の中ではごくシンプルな構造をしている(にもかかわらず、素晴らしい協同作用をもつ)ヘモグロビンを用いて、萌芽的な研究の手助けも行っています。たとえば、蛍光X線ホログラフィーは比較的新しい原子イメージング法ですが、タンパク質を対象としたホログラフィーは行われていませんでした。この世界初の試みにミオグロビン結晶とヘモグロビン結晶を提供しました(図3)。さらに、マクロな分子になると、従来の測定法や解析法にも改良の必要が出てくるため、そちらにも自治医大のメンバーが主体的に協力しました。こちらは新学術領域研究「3D活性サイト科学」の研究テーマのひとつです。