柴山 修哉 Naoya SHIBAYAMA

【研究分野】
- 生物物理学
- タンパク質科学
- 特にヘモグロビンの構造機能相関研究の第一人者
プロフィール
京都府宮津市生まれ。
大阪大学基礎工学部・森本研で1982年からヘモグロビンの研究を始める。
1985年に同大学院を休学渡米、ペンシルバニア大学医学部にてヘモグロビンの研究を続ける。
1987年より自治医科大学医学部物理学教室助手、1992年同講師。
2002年改組に伴い物理学教室は生理学講座生物物理学部門と名称を改め同講師、2012年より同教授、現在に至る。
「原理的に不可能でなければ決してあきらめない」をモットーに学生時代から一貫してヘモグロビンの構造機能相関研究を行ってきた。
研究内容
ヘモグロビン(Hb)はアロステリック調節(*用語解説)を示すタンパク質の代表格であり、X線結晶構造解析法が最初に適用されたタンパク質の一つでもあります。
α2β2型四量体のヒトHbは分子全体の構造を変化させて、4個のO2結合間の正のアロステリック調節(ヘム間相互作用)や、ヘムとは別の部位に結合する水素イオン、有機リン酸、CO2との負のアロステリック調節を絶妙なバランスで発現することにより、各組織の生理学的需要に応じたO2運搬を実現しています(図1)。
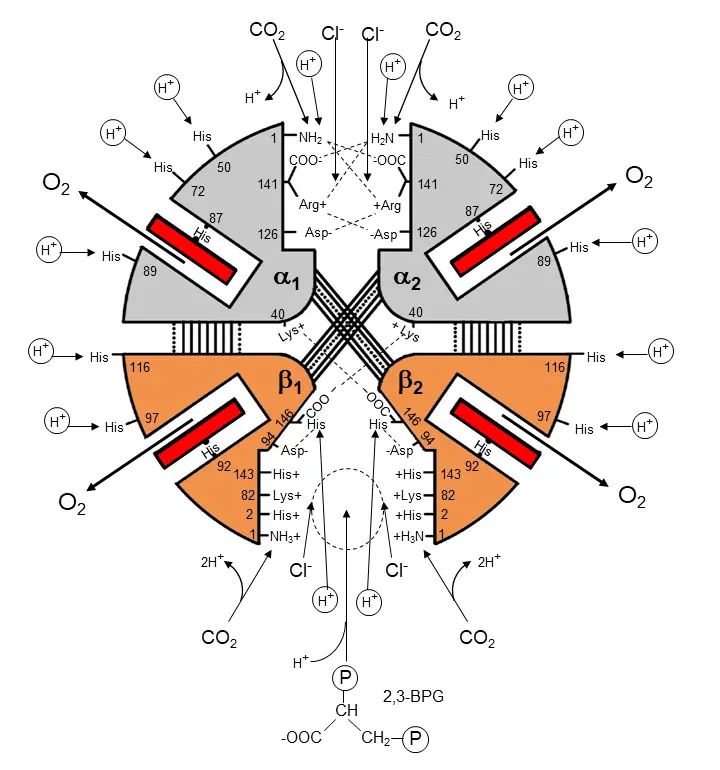
[柴山修哉(2010)人工血液18, 102]
Hbのアロステリック調節のメカニズムは、教科書的には、X線結晶構造解析で明らかにされたO2の結合していないデオキシT(tense)構造とO2の4個結合したオキシR(relaxed)構造の間の2状態転移(図2)で説明されています。
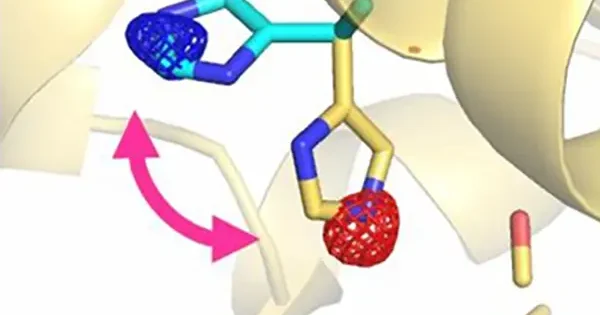
しかし、実際のHbはそれほど単純ではありません。最近、2状態転移では説明できない観測事例や計算結果が相次いで報告されています。一例を挙げると、我々は、独自に開発したHbの中間段階分子(O2が1~3個結合したHb)のモデルを用いたX線構造解析を行い、Hbの配位子結合と連動する立体構造変化は単純な2状態転移ではなく、多状態の間を行き来する複雑な過程(図3)であることを、単一結晶型中のT、Rを含む9種類の異なる立体構造を解くことで実証しました [Shibayama N. et al. (2014) JACS 136, 5097]。
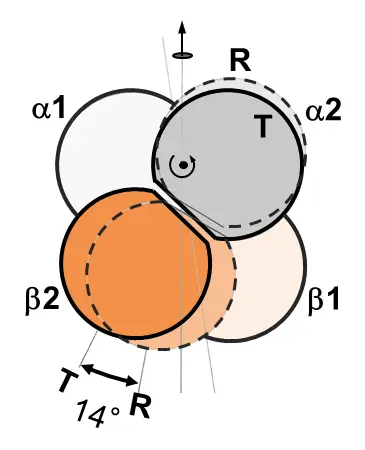
[Baldwin J & ChothiaC (1979) JMB129, 175]
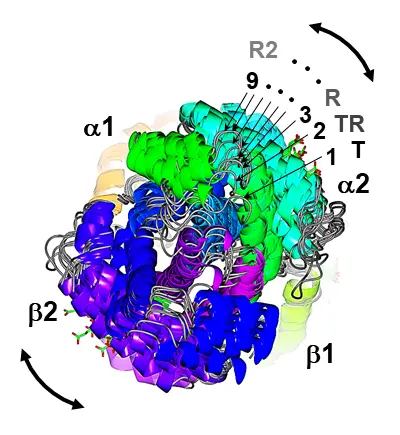
[Shibayama N. et al. (2014) JACS136, 5097]
10 Å以上の大きさを持ち、0.1 Åの桁で原子の位置を精密にコントロールしているタンパク質構造変化のメカニズムを理解するためには、Hbでもまだ構造変化の中間的状態の構造と機能に関する知見が決定的に不足していると言わざるを得ません。
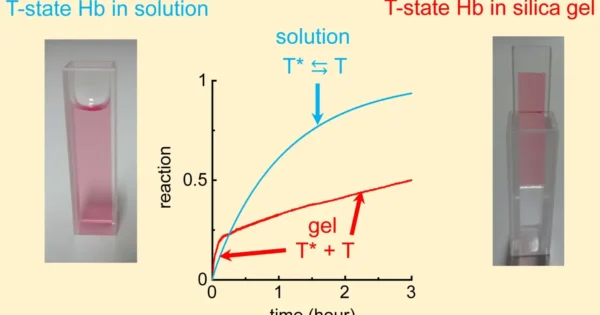
我々は、このような状況を打破するため、従来の構造解析法に加え、独自に開発した多孔性ゲル中(*写真1)、結晶中での機能解析法(*写真2)を駆使して、ヘモグロビンのとりうる構造と機能を直接関連付ける研究に取り組んでいます。
アロステリック調節:タンパク質分子が配位子やイオンの結合によりその高次構造を変化させ、分子上の別の部位の活性を大幅に変えることで実現されている調節法のこと。近年、多くのタンパク質が示す普遍的生命現象として更なる注目を集めている。
TOPICS
 2025年07月29日
2025年07月29日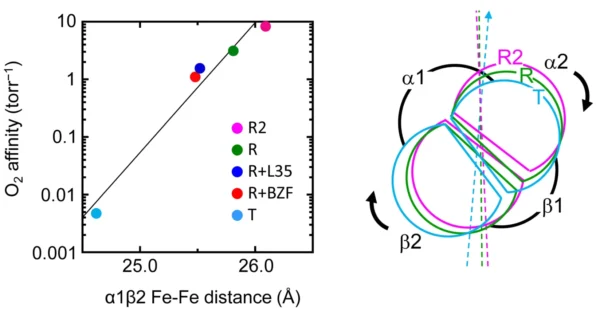 2025年07月29日
2025年07月29日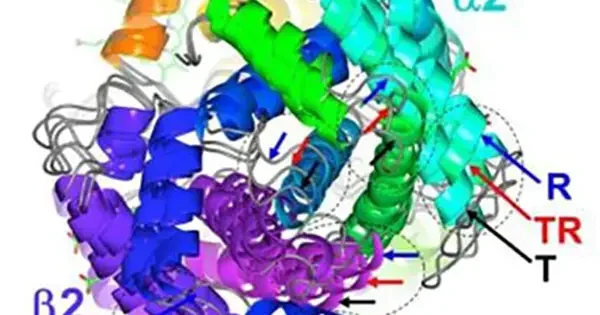 2024年08月09日
2024年08月09日