山本 直樹 Naoki YAMAMOTO

自治医科大学 医学部生理学講座生物物理学部門 講師
【研究分野】
- タンパク質、特にアミロイドーシスや神経変性疾患に関連したもの
- タンパク質と水和水の動的挙動の解明
研究内容
アミロイドーシスや神経変性疾患に関わるタンパク質の凝集機構解明
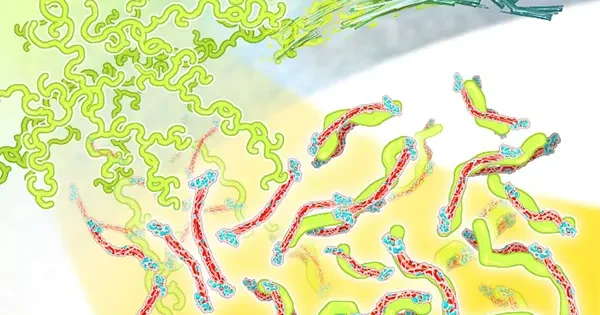
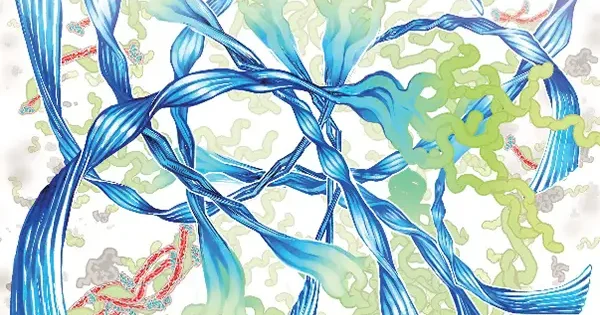
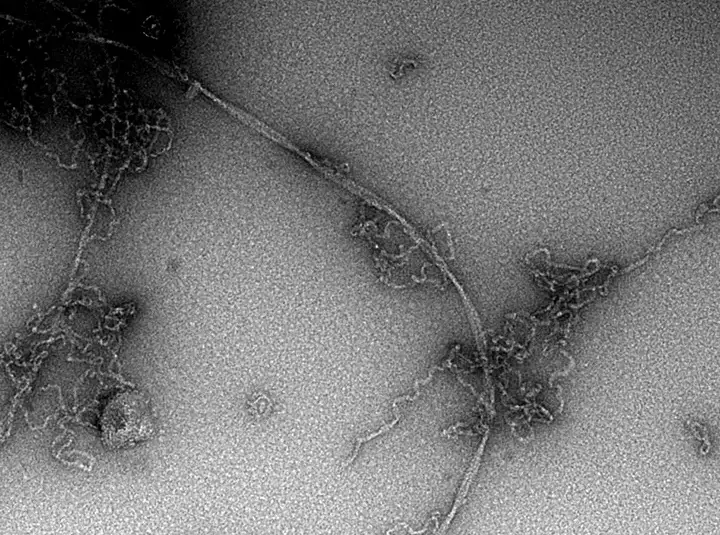
普段は正常な折り畳みをしているタンパク質はアミロイド線維という線維状の異常凝集体を形成し、全身性アミロイドーシスや、アルツハイマー病などの神経変性疾患の要因と考えられている。しかしながら、アミロイド線維の形成機構はいまだ不明な点が多く、完全な理解には至っていない。
アミロイド線維の形成には、しばしば中間体の形成が先立つことが知られており、中間体がアミロイド線維になる機序を明らかにすることは、アミロイド線維形成機構を理解するために重要である。また、中間体はアミロイド線維よりも細胞毒性が高い事が知られており、中間体を標的とした化合物はアミロイドーシスや神経変性疾患の治療につながる可能性を秘めている。
このような背景において、アミロイド形成モデルペプチドを用いて、中間体がアミロイド線維に変化する仕組みを調べてきた。例えば、一定の中間体を経由してアミロイド線維が形成される様子を明らかにしたり[1]、また中間体に結合するタンパク質がアミロイド線維化を阻害することを示してきた[2]。さらに、中間体がアミロイド線維に変化する詳細な様子を、電子顕微鏡などを用いて詳細に調べてきた[3]。
現在は、重篤な神経変性疾患やアミロイドーシスに関与するタンパク質を対象として、中間体の詳細な構造を調べたり、また中間体を分解する化合物の開拓を行っている。
アミロイド線維の形成には、しばしば中間体の形成が先立つことが知られており、中間体がアミロイド線維になる機序を明らかにすることは、アミロイド線維形成機構を理解するために重要である。また、中間体はアミロイド線維よりも細胞毒性が高い事が知られており、中間体を標的とした化合物はアミロイドーシスや神経変性疾患の治療につながる可能性を秘めている。
このような背景において、アミロイド形成モデルペプチドを用いて、中間体がアミロイド線維に変化する仕組みを調べてきた。例えば、一定の中間体を経由してアミロイド線維が形成される様子を明らかにしたり[1]、また中間体に結合するタンパク質がアミロイド線維化を阻害することを示してきた[2]。さらに、中間体がアミロイド線維に変化する詳細な様子を、電子顕微鏡などを用いて詳細に調べてきた[3]。
現在は、重篤な神経変性疾患やアミロイドーシスに関与するタンパク質を対象として、中間体の詳細な構造を調べたり、また中間体を分解する化合物の開拓を行っている。
[1] Yamamoto et al., Sci Rep. 2018 8(62)
[2] Yamamoto et al., Biochemistry 2019, 58(24), 2769-2781
[3] Yamamoto et al., J. Phys. Chem. B 2022, 126(51), 10797-10812
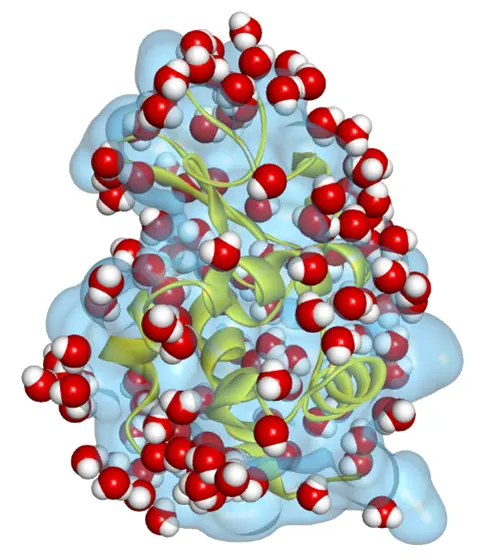
タンパク質とその周辺の水の動きの協働性を明らかにする研究
タンパク質周辺に存在する水分子は水和水と呼ばれ、タンパク質と共に動きながらそ の機能をアシストしていると考えられている。従って、タンパク質周辺の水和水の動的挙動、およびそれに伴って活性化されるタンパク質の動きを調べることは、タンパク質の動きと機能の関係性を明らかにするうえで重要である。
このような背景において、誘電分光およびテラヘルツ分光を組み合わせた広帯域誘電分光を用いて、球状タンパク質や膜タンパク質の水和水が温度上昇と共に活性化されていく様子の一端を明らかにしてきた[4,5]。また、水和水の中でも、特にタンパク質の動きの活性化に影響を与えるものについて、中性子散乱を用いて明らかにしてきた[6]。
このような背景において、誘電分光およびテラヘルツ分光を組み合わせた広帯域誘電分光を用いて、球状タンパク質や膜タンパク質の水和水が温度上昇と共に活性化されていく様子の一端を明らかにしてきた[4,5]。また、水和水の中でも、特にタンパク質の動きの活性化に影響を与えるものについて、中性子散乱を用いて明らかにしてきた[6]。
[4] Yamamoto et al., J. phys. Chem. B 2016, 120(21), 4743-4755
[5] Yamamoto et al., J. Phys. Chem. B 2018, 122(4), 1367-1377
[6] Yamamoto et al., J. Phys. Chem. Lett. 2021, 12(8), 2172-2176