新倫理指針が施行されました!
臨床研究の信頼性を確保するために以下の点にご注意ください。
・新規申請がシステムからの申請になりました。
https://www.jichi.ac.jp/kenkyushien/clinical/clinical_human/のページからダウンロードしてください。
・臨床研究に参加されるすべての医療者は倫理講習会受講とe-learning受講が必要です。
臨床研究に参加するすべての研究者は倫理講習会の受講(3年に1回)が必要です。
また、年1回以上、e-learningについても受講することが必須となりました。
http://www.jichi.ac.jp/kyousyokuin/e-learning.html
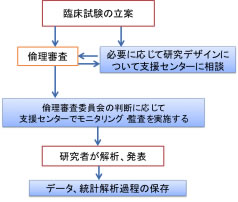
・モニタリング、監査が求められるようになりました。
新倫理指針では侵襲(軽微な侵襲を除く)を伴う介入研究についてはモニタリングと、必要に応じて監査を行うことが求められるようになりました。 事実上、前向きの臨床試験のほとんどにおいてモニタリングが必要になります。モニタリング、監査の方法について研究計画書に記載するとともに、モニタリングの手順書については臨床研究センターの書式を利用して計画を記載していただくことになりますが、モニタリングが必要な臨床研究等については、倫理審査委員会承認後(あるいは承認前)に臨床研究センターにデータ管理及びモニタリングの方法についてご相談ください。
・診療録等を用いる後方視的研究でも倫理審査とオプトアウトが必要です。
診療の向上を目的とした解析については倫理指針の対象外になりますが、学会発表、論文発表などを行う場合は臨床研究と見なされ、倫理指針の対象になります。あらかじめ倫理審査を受けるとともに、オプトアウト(インフォームド・コンセントを省略する代わりに、研究情報をホームページなどで通知・公開し研究対象者等が拒否できる機会を保障する方法)が必要です。
・臨床研究のデザインについてはiCRSTや臨床研究センターでサポートが可能です。お気軽にご相談ください。
[臨床研究センター管理部:内線2871、3794]