臨床研究法について(2018年4月1日施行)
臨床研究は、医薬品・医療機器等の開発候補物質が実用化可能かといった開発の探索的研究手段として、重要なものです。また、同種同効薬同士の有効性に関する比較研究や、手術と抗がん剤の組み合わせとの関係で最も効果的な医薬品投与時期の研究など、様々な診療ガイドライン等の検討を行う場面においても臨床研究が実施されています。
今般、医薬品等を人に対して用いることにより、その医薬品等の有効性・安全性を明らかにする臨床研究を法律の対象とすることとし、臨床研究の対象者をはじめとする国民の臨床研究に対する信頼の確保を図ることを通じてその実施を推進し、もって保健衛生の向上に寄与することを目的として、臨床研究の実施の手続、認定臨床研究審査委員会による審査意見業務の適切な実施のための措置、臨床研究に関する資金等の提供に関する情報の公表の制度等を定める「臨床研究法」が平成29年4月14日に公布され、平成30年4月1日に施行されました。
特定臨床研究の実施について
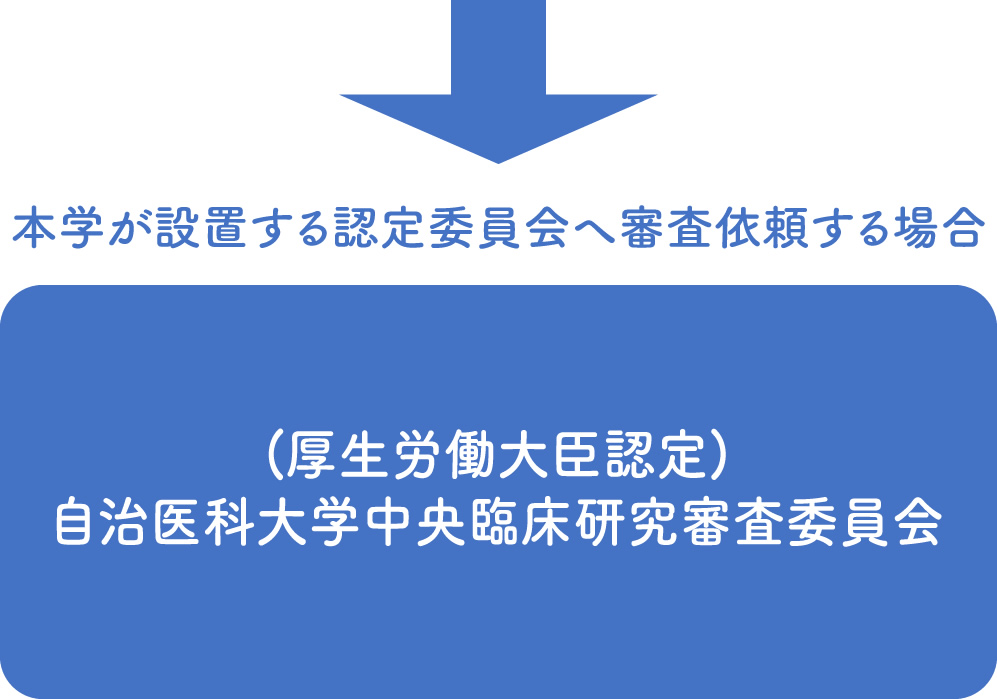
特定臨床研究を行う場合、国の定める「臨床研究法 ![]() 」に基づき実施しなければなりません。特定臨床研究を実施する際には、厚生労働大臣から認定を受けた認定臨床研究審査委員会で審査を受け、実施医療機関の管理者の承認を受ける必要があります。
」に基づき実施しなければなりません。特定臨床研究を実施する際には、厚生労働大臣から認定を受けた認定臨床研究審査委員会で審査を受け、実施医療機関の管理者の承認を受ける必要があります。