|
||
 |
|
世界がボーダレス化する中、重症熱性血小板減少症やデング熱に代表されるように、わが国において予想もしなかった感染症が侵入するようになってきた。また交通網の発達に伴う人や物の移動や、地球レベルでの環境変動に伴い、それらを媒介する節足動物(ベクター)も侵入・定着する可能性がある。これら節足動物媒介感染症への対策としては、治療法・予防法の開発とともに、感染源や感染経路などのリスクファクターを明らかにすること、感染・伝播メカニズムを解明することは不可欠である。また近年、ベクターは単なる病原体の運び屋ではなく、ベクターの唾液が宿主の生理機能や免疫機構、さらには病原体感染にまで様々な形で影響を及ぼすことが明らかにされつつある。我々は現在、以下の研究を中心に行っている。 |
||||
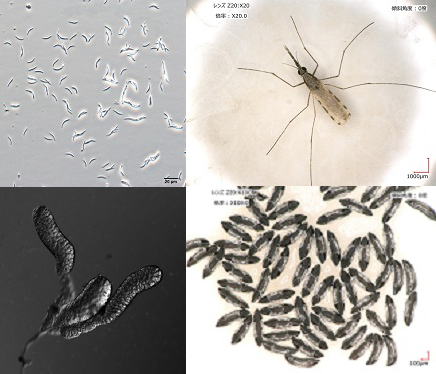
| | リーシュマニア症の疫学調査研究 リーシュマニア症は、体長2-3mm(蚊の1/3程度)の微小な吸血昆虫サシチョウバエに媒介されるリーシュマニア 原虫によって引き起こされる人獣共通感染症である。本症は98か国で1,200万人以上の患者が報告され、世界保健機構(WHO)による8つの重要熱帯感染症の1つとして、“顧みられない熱帯病(Neglected Tropical Diseases)”の1つとしても知られている。ヒトに病気を引き起こすリーシュマニア原虫は約20種報告されており、感染種と病態が密接に関連することから、感染種を明らかにすることは感染者の治療や予後判断に重要である。また、800種以上いるサシチョウバエの一部の種がそれぞれ特定の原虫種を媒介することから、分布サシチョウバエ種やベクター種の特定はベクターコントロールやリスク管理において重要である。本研究では、リーシュマニア症の疾患流行地(エクアドル、ペルー、タイなど)で疫学調査を行い、その伝播疫学に関する調査研究を行っている。また、分子診断法や簡易血清診断法の開発、感染者、ベクターおよび保虫動物からの病原体検出・同定法の開発、大規模ベクター調査法の確立などを行い、疾患流行地での疫学調査に応用している。 |
||||
参考論文 1. Kato et al., PLoS Negl Trop Dis. 10: e0004844, 2016. 2. Kato et al., PLoS Negl Trop Dis. 10: e0004728, 2016. 3. Kato et al., PLoS Negl Trop Dis. 10: e0004336, 2016. 4. Koarashi et al., Acta Trop. 158: 83-87, 2016. 5. Nzelu et al., Acta Trop. 153: 116-119, 2016. 6. Kato et al., Acta Trop. 141: 79-87, 2015. 7. Gomez et al., Acta Trop. 137: 118-122, 2014. 8. Nzelu et al., Acta Trop. 132: 1-6, 2014. 9. Kato et al., Acta Trop. 128: 710-713, 2013. 10. Kato et al., Trans R Soc Trop Med Hyg. 105: 561-567, 2011. 11. Kato et al., Vector Borne Zoonotic Dis. 11: 515-521, 2011. 12. Kato et al., J Clin Microbiol 48: 3661-3665, 2010. 13. Kato et al., Parasit Vectors 3: 10, 2010. |
 |
|||
|
|
||||
| | 吸血昆虫の唾液が病原体感染に及ぼす役割の解明 吸血性節足動物の唾液は、血小板凝集阻害、血液凝固阻害、血管拡張、抗炎症などの作用をあわせ持つ“生理活性物質のカクテル”で、これを宿主に注入することで効率よく吸血を行う。近年、様々な吸血性節足動物の唾液から種によって異なるユニークな生理活性物質が単離され、医薬品や検査・研究試薬への応用を目指す研究がすすめられている。また、病原体を媒介する吸血性節足動物(ベクター)の唾液には、病原体の感染を増強する作用があることも報告されており、ベクターは単なる病原体の運び屋ではなく、唾液を介して病原体感染に積極的に関与していると考えられる。血液凝固系と炎症・免疫応答は互いに密接に関係することが明らかになってきており、吸血性節足動物が吸血のために進化させてきた唾液の生理活性の一部が、病原体の感染を助長する作用を持つと考えられる。その一方で、ベクターの唾液によって宿主に誘導されるある種の免疫応答が、宿主を病原体の感染から守る、すなわち、病原体とは無関係なベクターの唾液成分が感染症のワクチンになる可能性も報告されている。本研究では、吸血昆虫の唾液から哺乳類の生理機能や免疫機構に影響を及ぼす物質を探索し、医薬品や検査・研究試薬(抗凝固、血管拡張、免疫制御、発痛抑制)への応用を目指す。また、吸血昆虫の唾液による病原体感染増強メカニズムの解析や、宿主に感染防御免疫を付与する唾液物質を明らかにして唾液ワクチンの開発を目指す研究などを行っている。 |
||||
参考論文 1. Kato et al., Biochimie. 112: 49-56, 2015. 2. Kato et al., Infect Genet Evol. 13: 56-66, 2013. 3. Ishimaru et al., J Exp Biol. 215: 3597-3602, 2012. 4. Kato et al., Infect Genet Evol. 10: 184-191, 2010. 5. Hamasaki et al., J Insect Physiol. 55: 1044–1049, 2009. 6. Kato et al., J Exp Biol. 210: 733-740. 2007. 7. Kato et al., BMC Genomics. 7: 226. 2006. |
 |
|||
|
|
||||
| | ハマダラカにおけるマラリア原虫寄生メカニズムの解析 遺伝子改変技術を利用した蚊の吸血及び生殖機構の解析と制御に関する研究 マラリアは世界3大感染症の一つで、未だに年間約50万人もの人々が命を落としている。マラリアは媒介動物(ベクター)であるハマダラカの吸血を通して感染する。マラリア対策として、ハマダラカのコントロールはワクチン開発と並んで非常に有効である。したがってハマダラカおよび蚊ステージのマラリア原虫の解析はハマダラカの新しいコントロール法開発につながる重要な課題である。本研究ではハマダラカ—マラリア原虫間の相互作用の解析や、ハマダラカの吸血および生殖に関わる遺伝子の解析を行い、それらの機構を明らかにすることを目指している。遺伝子組換え(トランスジェニック)技術やゲノム編集技術を利用してハマダラカ生体内での機能解析を行っている。また、本研究で得た知見や技術をもとに、マラリア非媒介蚊の作製や不妊化技術の開発を行っている。ハマダラカ の遺伝子機能解析では多数の遺伝子改変した蚊の系統を作出するが、培養細胞やマウス受精卵の凍結保存法のような安定した系統保存 技術が蚊では存在しない。これは世界中のハマダラカ研究者 にとっても大きな負担になっている。そこで、本研究ではハマダラカの系統保存技術の開発も行っている。 |
||||
| 参考論文 1. Yamamoto et al., PLoS Pathog. 12(9): e1005872, 2016 press release 2. Yamamoto et al., Insect Mol Biol. 22: 685-693, 2013 3. Yamamoto et al., J Exp Biol. 216: 2960-2966, 2013 4. Sumitani et al., Insect Mol Biol. 22: 41-51, 2013 5. Iyori et al., PLoS one. 8: e70819, 2013 6. Matsuoka et al., Trop Med Health. 40: 47-52, 2012 7. Yamamoto et al., Insect Mol Biol. 21: 223-233, 2012 8. Yamamoto et al., Insect Mol Biol. 19: 391-398, 2010 9. Hatakeyama et al., Proc Arthropod Embryo Soc Jpn. 44: 1-12, 2009 10. Yamamoto et al., Mech Dev. 125: 996-1008, 2008 11. 日本経済新聞記事掲載(平成28年7月17日23面) |
 |
|||
|
|
||||
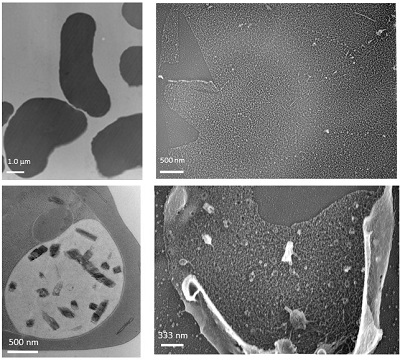
| | 熱帯熱マラリア原虫が感染した赤血球内におけるタンパク質輸送機構の解明 マラリアは世界三大感染症の1つで、中でも重症化が問題となっている熱帯熱マラリアは、ハマダラカによって媒介されたマラリア原虫がヒトの体内に侵入し、肝臓を経て赤血球に侵入することで感染が確立する。近年、地球温暖化の影響によりマラリアを媒介する蚊の生息地域が北上していること、ある種の薬に対しマラリアが生物学的・環境学的因子により巧みに薬剤耐性を獲得していること、現在もマラリアワクチンの開発が成功していないことなどの現状から、国内・国外双方の問題として早急に基礎研究を推進させるとともに、薬やワクチンの開発など、近い将来Translating Researchとして発展させる必要がある。熱帯熱マラリア原虫は赤血球に侵入後、数百種に及ぶと言われている自己のタンパク質を赤血球膜に輸送する。原虫由来のタンパク質のうち幾つかは深刻な病原性の発現に直接関与していることが知られている。しかし、脱核後の赤血球内でマラリア原虫がどのようにして自己のタンパク質を輸送しているのか、そのメカニズムは不明である。もし、赤血球内でのタンパク質の全輸送システムが解明されれば、病原性を伴うタンパク質の発現を制御し、マラリアに対する新たな治療法・治療薬の有力な候補となる。本研究では、マラリア原虫が感染した赤血球内部にのみ構築されるマウラーズクレフト(MC)という脂質膜が、タンパク質輸送の「輸送体、輸送経路」として機能している可能性に着目し、MC膜の構造解析、機能解析、発生機構の解析などを行っている。特MC膜の構造解析においては、特殊な試料作製方法でマラリア原虫感染赤血球の内部構造を「露出」させることに成功し、MC膜を含む感染赤血球の内部構造に対し、ナノオーダーでの超微細構造を透過性電子顕微鏡(TEM)により検出することに成功している。また、原虫由来のタンパク質が赤血球膜表面に輸送された後、赤血球膜の構造がどのように変化するのかについても、異なる宿主(ヒト、マウス、鳥類など)において比較検討を行っている。 |
||||
参考論文 1. Hayakawa et al., Exp Parasitol. 153: 174–179, 2015 2. Hayakawa et al., BioMed Res Int. 2015 642729, 2015 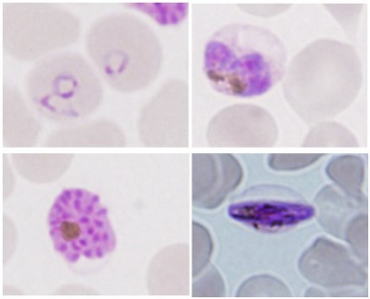 |
 |
|||
|
|
||||
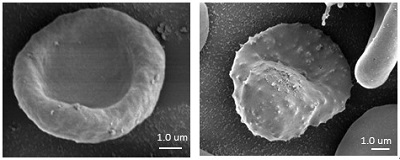
| | 感染症における細胞膜/オルガネラ膜を反応場とした膜機能の解明 ウィルス、細菌、原虫などを病原体とするほとんどの感染症は、宿主細胞の細胞膜を介して感染イベントを確立させる。これらの感染イベントの確立には、宿主細胞膜における脂質マイクロドメイン(ラフト)が重要な役割を担っていることが、近年わかってきた。さらに脂質マイクロドメインの主要構成脂質であるコレステロールの存在は、細胞内情報伝達、膜融合、エキソサイトーシス、エンドサイトーシス等にみられる膜タンパク質の活性にも深く関わっていることがわかってきた。このように細胞膜、オルガネラ膜などの「膜」の性質、機能を 明らかにすることは、感染症における感染防御、感染後の細胞内イベントの解明、治療法の模索などにとどまらず、多様な研究領域における細胞機能を解明する上で重要な因子である。本テーマに関しこれまでに、マクロファージ内に取り込まれた結核菌のサバイバルスキルの解明として、結核菌由来の糖脂質lipoarabinomannan)がファゴソーム膜の脂質マイクロドメイン構造を調節することで、ファゴソーム-リソソーム膜融合(P-Lfusion)が阻害され、その結果、結核菌が生存可能となることを生物物理学的手法により明らかにしてきた。また、マラリア原虫侵入した感染赤血球膜では、細胞骨格や脂質分子の分布、脂質‐膜タンパク質相互作用、原虫由来タンパク質と赤血球膜との相互作用などが、非感染赤血球と比較して変化していることを明らかにした。さらに、赤血球内に存在するヘモグロビンの「型」の違いによる赤血球膜内のラフト構造の違いなどについても検討を行っている。現在は、マラリア原虫の脂質代謝、外部からの脂質の取り込み機序と感染赤血球内部に構築される種々の膜の形成との関係、それらの構造、機能の解明等について、生化学的、生物物理学的手法により検討を行っている。また、これらの検討をする上で重要な測定方法の1つとしている電子顕微鏡イメージングにおいて、新たなサンプル作成法の開発も行っている。 |
||||
参考文献 1. Hayakawa et al., Biophys J. 93: 4018–4030, 2007. 2. Tokumasu et al., PLoS ONE. 4: e5828, 2009. 3. Hayakawa et al., PLoS ONE. 8: e85467, 2013. 4. Hayakawa et al., BioMed Res Int. 2015: 642729, 2015. 5. Hayakawa et al., Parasitol Int. 65: 539-544, 2016. |
  |
|||
| | 吸血昆虫の病原体媒介能を規定する中腸因子の解析 節足動物媒介感染症であるリーシュマニア症やマラリアは、病原体であるリーシュマニア原虫やマラリア原虫に感染した吸血性節足動物(ベクター)によってヒトへ伝播する。従来、ベクターの病原体媒介能は、それらの“種”に規定されると考えられているが、両者の間にはどのような機構が関与して、どのように制御されることで規定されているのかは不明である。病原体は、ヒトへの感染を成立させるべく、ベクターの消化器官である中腸でヒト感染性の形態へと発育する。ヒトの腸と同様に、ベクターの中腸は、生命活動の維持に必要な栄養源を吸収するだけでなく、有益な腸内細菌叢を維持していく上で重要な免疫反応が繰り広げられる環境でもある。本研究では、病原体媒介能を規定する因子並びに制御機構を明らかにするため、ベクター中腸における免疫応答・腸内細菌叢・原虫の生理反応に注目し解析している。また、得られた知見を基に新たなベクターコントロール法開発への応用を目指す。 |
||||
|
|
||||
| Copyright@Division of Medical Zoology, Department of Infection and Immunity,
Jichi Medical University all right researved. No reproduction or republication without written permission. |
||||