抗加齢医学研究部では、これまでの老化研究の潮流とは異なる視点で「老化」の研究をしています。
これまでの老化研究は、酵母から線虫、ショウジョウバエ、マウス、霊長類に至るまで、種を超えて保存されている老化のメカニズムを追求してきました。その結果、適度なカロリー制限や成長抑制が実験動物の寿命を延ばすことや、老化細胞の蓄積が個体老化を加速することなどが明らかとなりました。これらの研究成果を受けて最近では、カロリー制限時の代謝状態を誘導する薬(カロリー制限模倣薬)や老化細胞を選択的に殺す薬(老化細胞除去薬)の開発が進んでいます。もしこれらの薬が将来、人類の健康寿命を延ばすことが証明されたら大変素晴らしいと思います。
しかし私たちは、これまでの老化研究とは全く異なるアプローチで「健康寿命の延長」を実現することを考えています。すなわち、種を超えて保存されている老化のメカニズムではなく、これまであまり研究されてこなかった高等動物に特有の老化のメカニズムを追求することで、安全で確実に人類の健康寿命を延長できる実践的な抗加齢医学を迅速に構築することを目指しています。
そのために私たちがどのような研究をしているのか、興味のある方は是非「研究について」のリンクをご覧ください。
研究内容
クロトー(Klotho):老化抑制遺伝子?
私共の研究は、20年程前、ある突然変異マウスを発見したことに端を発しています。ある遺伝子が機能しないために、ヒトの老化に良く似た症状を次々と発症して早死にしてしまうマウスです。私共は、この「早老症マウス」で欠損している遺伝子を同定し、ギリシャ神話の「生命の糸」を紡ぐ女神の名に因んで「クロトー(Klotho)遺伝子」と命名しました(Kuro-o M, et al. Nature 390:45-51, 1997)。逆にKlotho 遺伝子を過剰発現するマウスを作成したところ、老化が遅れ、普通のマウスより長生きしました (Kurosu H, et al. Science 309:1829-1833, 2005)。つまりKlotho 遺伝子は、欠損すると老化を加速し、過剰発現すると寿命を延ばす「老化抑制遺伝子」と考えられます。
Klotho 遺伝子の機能
Klotho 遺伝子のコードする蛋白(Klotho 蛋白)は、一回膜貫通型の膜蛋白で、FGF23 というホルモンの受容体として機能します(Kurosu H, et al. J Biol Chem 281:6120-6123, 2006)。FGF23(fibroblast growth factor-23)はリンの恒常性維持に必須のホルモンです。食事でリンを摂取すると、何らかの機構で骨(骨細胞)がそれを感知し、FGF23 を分泌します。FGF23 は血中を流れ、腎臓に発現しているKlotho 蛋白とFGF 受容体の複合体に結合し、尿中へのリン排泄を促進します。こうして リンの収支バランスを保ち、体にリンが不必要に蓄積するのを防いでいます。
リンって、何?
リンは、あらゆる生命体を構成する6大元素(炭素、窒素、水素、酸素、硫黄、リン)の一つです。リンは様々な生命現象に重要な役割を果たしています。リン脂質として細胞膜を構成し、アデノシンリン酸(ATP、ADP、AMP)としてエネルギー代謝の主役を演じ、また、細胞内ではリン酸化によるシグナル伝達を司っています。ヒトの体の中では、リン酸カルシウム結晶の形で骨に大量に存在します。進化の過程で、リン酸カルシウム結晶から出来た骨を持つようになったのは魚類からです。さらに水中から陸に上がった両生類以降は、これまで水の浮力の助けで支えていた体を、重力に抗して骨で支えなくてはならなくなり、固いリン酸カルシウムの骨格が必要となったと考えられます。しかしそのためには、リン酸カルシウム
結晶を骨でのみ析出させ、体の他の部分では析出させない仕組みが必要であり、細胞外液中のリン濃度を厳密に管理するシステムが必要です。Klotho 遺伝子は、リン酸カルシウムの骨を持つ生物にのみ存在します。Klotho は、まさにリン代謝制御のために進化してきた遺伝子と考えられます。実際、Klotho 遺伝子が欠損すると、余分なリンを尿中に排泄できなくなり、リンが溜まって骨以外の軟部組織(特に血管)にリン酸カルシウム結晶が析出してしまいます。
リンと老化
では、なぜKlotho が欠損してリンのバランスが崩れると老化が加速するのでしょうか。これが私共の現在の研究テーマのひとつです。リンのバランスが崩れると、血中や尿中にもリン酸カルシウム結晶が出現します。しかし、血中や尿中では、結晶が大きく成長できないような防御機構が働くので、非常に小さな結晶しか出来ません。このリン酸カルシウムの微小結晶をCalciprotein particle(CPP)といいます。CPP はコロイド粒子として血中や尿中を流れます。私共は、このCPP が、あたかも病原体のように慢性炎症を引き起こし、血管や心臓、腎臓など様々な臓器を障害して老化を加速するのではないか、と考えています。この仮説を私共は「CPP 病原体説」として提案してきました(Kuro-o M. Nat Rev Nephrol, 2013)。
私共の研究部は、「CPP 病原体説」を証明し、CPP を老化の診断・治療の標的分子として確立することを目指しています。
Klotho の発見から新しい内分泌系の発見へ
リン利尿ホルモンFGF23 は、FGF(線維芽細胞成長因子)の一種であるにもかかわらず、生理的濃度ではFGF 受容体(FGFR)にほとんど結合しません。しかし、FGF 受容体がKlotho 蛋白と複合体を形成すると、その複合体には非常に高い親和性で結合します。FGF 受容体は様々な臓器に発現していますが、Klotho の発現は腎臓などに限られています。つまり、Klotho の発現がFGF23 の標的臓器を決定しているということです。
Klotho と相同性の高い遺伝子がデータベース上で見つかり、βKlotho と名付けられました。βKlotho と区別する必要がある時は、オリジナルのKlotho をαKlotho と呼ぶこともあります。つまりKlotho にはαKlotho とβKlotho の2種類がある、ということです。どちらもFGFR と複合体を形成する性質があります。αKlotho はリン利尿ホルモンFGF23 の受容体として働きますが、βKlotho は、FGF19 とFGF21というホルモンの受容体として働きます。
FGF19 は、摂食時に小腸から分泌され、肝臓に発現するβKlotho に作用し、食後の代謝変化を誘導する「飽食ホルモン」です。一方、FGF21 は、空腹時に肝臓から分泌され、脂肪細胞に発現するβKlotho に作用し、空腹時の代謝変化を誘導する「飢餓ホルモン」です。FGF19 とFGF21 は、丁度インスリンとグルカゴンのように、糖脂質代謝をコントロールしているホルモンであることが分かってきました。
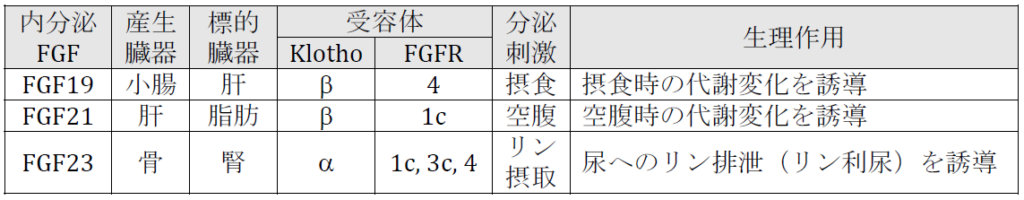
2つのKlotho と3つのFGF が、様々な代謝過程を制御する複数の内分泌系を構成していることが、私共の研究部の研究から明らかとなりました。これらKlotho-FGF 内分泌系は、その機能を考えると、さまざまな生活習慣病の病態、ひいては老化にも関わることが予想されます。私共の研究部では、Klotho-FGF 内分泌系を診断・治療の標的とした新たな医療の開発も目指しています。
