自治医科大学中央臨床研究審査委員会について
自治医科大学中央臨床研究審査委員会(厚生労働大臣認定)では、
臨床研究法に基づく臨床研究の実施計画について意見を求められた場合に、
臨床研究法施行規則に則り、倫理的及び科学的視点から審査意見業務を行います。
※人を対象とした医学系研究に関する倫理指針に基づき実施する研究に関しては別のHPにてご案内しております。
※※CRB審査後の手続きに関しては別のHPにてご案内しております。(学内専用ページへ移動します。)
委員会情報
・名称: 自治医科大学中央臨床研究審査委員会
・英語表記:Jichi Medical University Central Clinical Research Ethics Committee
・認定番号:CRB3200006
・所在地: 栃木県下野市薬師寺3311-1
■認定証1 令和2年12月17日から令和5年12月16日 PDF:148KB
■認定証2 令和5年12月17日から令和8年12月16日 PDF:13KB
連絡先はページ下方にございます。お電話で対応できないことがございます。お手数をおかけいたしますが、メールでのお問い合わせをお願いいたします。
規程・手順書
委員名簿
委員会開催日程と受付状況
申請はメールにて受付いたします。(連絡先)
審査をご希望の方は、申請期限までに、メールにてご連絡ください。変更・各種報告の場合には、開催日の20日~17日前までを目安に申請をお願いいたします。
※特定臨床研究の開始時手続きに関するチェックリスト![]() :145KB 厚生労働省HPより
:145KB 厚生労働省HPより
◎受付期限は、全ての申請資料が整っていることを事務局が確認した日(確定日)となります。資料提出日ではありませんので、ご注意ください。
また、「簡便な審査」は適宜開催いたしますので、「簡便な審査」に該当する変更は随時ご相談ください。
- 受付期限に提出された場合でも、書類の不備や、技術専門員の評価に時間を要した場合などは予定通りの審査にはならない場合もございます。
- 変更や各種報告の場合でも技術専門員の評価が必要となった場合、申し込み期限までに申請いただいても審査予定日に審査できない可能性があります。
- 新規申請は、研究責任医師(研究代表医師)に委員会へ出席いただき、研究内容の説明をお願いしております。(WEB会議対応可能)
※新規の継続審査に係る再提出の期限は、個別に設けております。審査結果通知時にご案内する期限をご確認下さい。
2025年度開催予定
| 開催日 | 新規 (受付期限◎) |
受付状況 | 変更 各種報告 (受付期限◎) ※新規の継続審査に係る再提出は除く |
受付状況 |
|---|---|---|---|---|
| 2025年4月28日 | 2025年3月3日 | 受付終了 | 2025年4月11日 | 受付終了 |
| 2025年5月26日 | 2025年3月31日 | 受付終了 | 2025年5月9日 | 受付終了 |
| 2025年6月23日 | 2025年4月21日 | 受付終了 | 2025年6月6日 | 受付終了 |
| 2025年7月28日 | 2025年6月2日 | 受付終了 | 2025年7月10日 | 受付中 |
| 2025年8月25日 | 2025年6月30日 | 受付中 | 2025年8月7日 | 受付中 |
| 2025年9月29日 | 2025年8月1日 | 受付中 | 2025年9月11日 | 受付中 |
| 2025年10月27日 | 2025年9月1日 | 受付中 | 2025年10月9日 | 受付中 |
| 2025年11月17日 | 2025年9月29日 | 受付中 | 2025年10月31日 | 受付中 |
| 2025年12月22日 | 2025年10月24日 | 受付中 | 2025年12月5日 | 受付中 |
審査手数料
| 新規審査手数料 (新規審査及び1年目の各種報告等に係る審査) |
90,000円(税別) |
| 廃止となる委員会から審査を引き継ぐ場合 (新規審査と同様に取り扱います) |
90,000円(税別) |
| 2年目以降の審査手数料 (1年毎・定期報告時に請求 変更・各種報告含む) |
80,000円(税別) |
審査手数料はいかなる場合であっても返還は致しませんのでご了承ください。
審査の流れ
フロー中の日数は目安です。
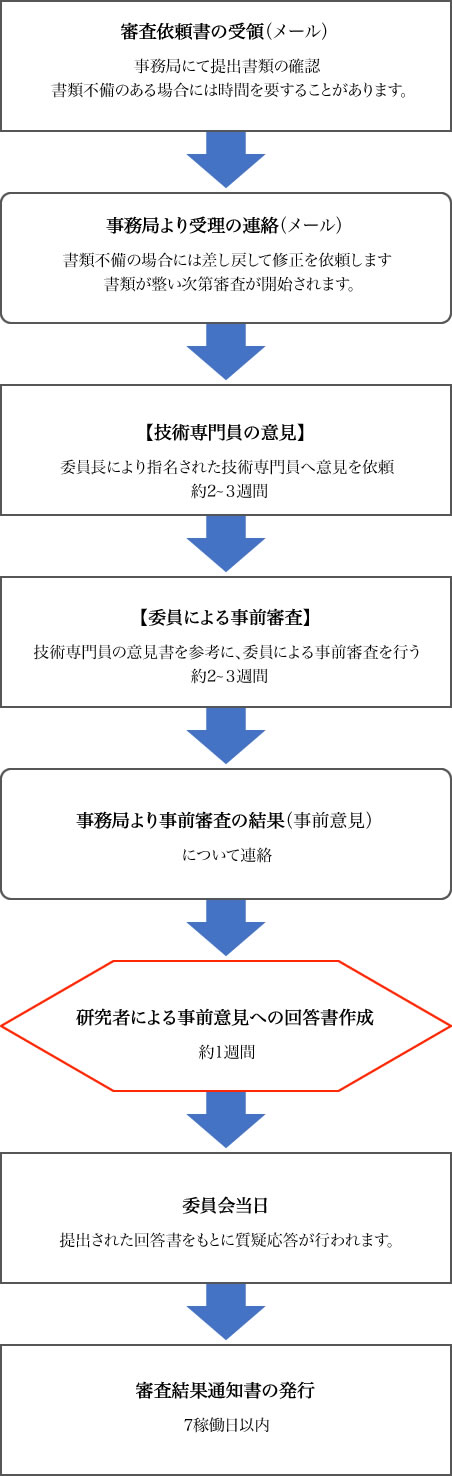
必要書類について
審査書類は原則申請者にご準備いただいております。
提出方法の詳細については、書類受理後にご連絡いたします。
当委員会では、統一書式を使用しております。
☆特定臨床研究の開始時手続きに関するチェックリスト![]() :145KB 厚生労働省HPより
:145KB 厚生労働省HPより
最新の統一書式については厚生労働省の【臨床研究法について】をご確認ください。(http://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html)
なお、受付後、委員長宛となる依頼書、報告書等には、原則押印をいただいております。
■新規申請
| 1 | 新規審査依頼書 | 統一書式2 | 様式中の資料名と提出書類は整合させてください。 押印必要 |
| 2 | 実施計画 | 省令様式第一 | jRCTで作成し、一時保存したものをPDF出力してください。 |
| 3 | 研究計画書 | 任意様式 | |
| 4 | 説明文書・同意書 | 任意様式 | |
| 5 | 医薬品等の概要を記載した書類 | 既承認の医薬品、医療機器の場合は添付文書や仕様書、医薬品等の管理手順書 | |
| 6 | 疾病等が発生した場合の対応に関する手順書 | 作成した場合(研究計画書に記載されていれば別途作成は不要。)
※手順書と計画書の記載内容が同じ場合でも、手順書を別途作成した場合には提出。 |
|
| 7 | モニタリングに関する手順書 | 〃 | |
| 8 | 監査に関する手順書 | 〃 | |
| 9 | 統計解析計画書 | 〃 | |
| 10 | 利益相反管理基準 | 様式A | リンクから利益相反の様式をダウンロードしてください。研究全体で1計画です。 |
| 11 | 利益相反管理計画 | 様式E | リンクから利益相反の様式をダウンロードしてください。実施医療機関毎に作成する。 |
| 12 | 研究責任医師の履歴書 | 統一書式 (参考書式4) |
実施医療機関すべて(押印は不要) |
| 13 | 分担医師リスト | 統一書式1 | 実施医療機関すべて(押印は不要) |
| 14 | 実施医療機関の要件確認書および各施設確認シート | 作成した場合 統一書式 (参考書式2-1) |
別の書類にて要件が確認可能な場合や各施設の症例数を示す書類を別途作成した場合には、必須ではないが、救急体制を持たない小規模施設が含まれる場合には作成したほうが望ましい。 |
| 16 | 医薬品等製造販売業者又はその特殊関係者との資金提供に関する書類 | 当該特定臨床研究の実施のために資金提供がある場合。その契約状況等が確認できる書類。
都合上、非公開の箇所についてはマスキング可 |
|
| 17 | 被験者の保障 | 説明文書の別紙とした場合 | |
| 18 | 補償に関する内容 | 臨床研究保険に加入する場合(見積書・付保証明など) | |
| 19 | その他 | 広告、参加カード等の配布物(作成した場合) | |
■変更申請 ※実施計画の軽微変更に該当する場合には 統一書式14(押印必要)に実施計画事項軽微変更届出書(提出日あり)を添えて通知してください。
| 1 | 変更申請書 | 統一書式3 | 書式中に書ききれない場合には別紙を作成してください。 押印必要 |
| 2 | 実施計画事項変更届出書 | 省令様式第二 | jRCTで作成し、一時保存したものをPDF出力してください。 実施計画の変更を伴わない場合は不要 |
| 3 | 実施計画 | 省令様式第一 | jRCT上で変更後、一時保存したものをPDF出力してください。 実施計画の変更を伴わない場合は不要 |
| 4 | 変更(追加)される書類 | 委員会で審査されている書類に変更や追加がある場合は必ず提出。 | |
| 5 | 変更対比表 | 研究計画書・ICF・各手順書の変更の場合は必須とする。
変更内容がわかるように対比表等を作成する。 |
|
■疾病等報告
| 1 | 医薬品 | 統一書式8 | 研究内容によって該当するものを提出
押印必要 |
| 医療機器 | 統一書式9 | ||
| 再生医療等製品 | 統一書式10 | ||
| 2 | その他 | 効果安全性評価委員会等の評価書など。報告にあたって追加情報がある場合には提出。 | |
■重大な不適合報告
| 重大な不適合報告書 (統一書式7) |
書ききれない場合には別紙を作成する 押印必要 |
■定期報告
| 1 | 定期報告書 | 統一書式5 | 委員会あて 押印必要 ※定期報告時点での書類一覧別紙はこちら |
| 2 | 定期報告書 | 別紙様式3 | jRCT上で変更後、一時保存したものをPDF出力してください。 |
| 3 | 利益相反管理基準 | 様式A | |
| 4 | 利益相反管理計画 | 様式E | 報告期間中の実施医療機関 |
| 5 | 分担医師リスト | 審査済のもの | 各実施医療機関の利益相反管理計画に紐づくもの |
■中止
| 1 | 中止通知書 | 統一書式11 | 委員会あて(押印必要) |
| 2 | 特定臨床研究中止届書 | 省令様式第4 | jRCT上で作成し、一時保存後にPDF出力してください。 |
■終了
| 1 | 終了通知書 | 統一書式12 | 押印必要 |
| 2 | 終了届書 | 別紙様式1 | jRCT上で作成し、一時保存したものをPDF出力してください。 提出時の日付は未記入もしくは統一書式12と同じ日付としてください。終了届書書き方 |
| 3 | 総括報告書 | 自由様式
【注意】 施行規則第24条第2項関係 運用通知(25)③では、少なくとも以下の4項目を含めることが規定されています。 |
|
申請・お問い合わせ先
自治医科大学中央臨床研究審査委員会事務局
TEL 0285-58-7637
FAX 0285-44-1256
E-mail jmu-crb2020※jichi.ac.jp
(【※】は【@】へ変換してください。)
事務局は自治医科大学附属病院 臨床研究センター管理部に設置しています。
担当者が不在となる場合があります。メールでのお問い合わせをお願いいたします。
委員会議事録
- 第38回 2023年12月18日開催:(PDF265KB)
- 第39回 2024年1月29日開催:(PDF223KB)
- 第40回 2024年2月26日開催:(PDF263KB)
- 第41回 2024年3月25日開催:(PDF236KB)
- 第42回 2024年4月22日開催:(PDF273KB)
- 第43回 2024年5月27日開催:(PDF297KB)
- 第44回 2024年6月24日開催:(PDF237KB)
- 第45回 2024年7月29日開催:(PDF203KB)
- 第46回 2024年9月30日開催:(PDF245KB)
- 第47回 2024年10月28日開催:(PDF210KB)
- 第48回 2024年12月23日開催:(PDF218KB)
- 第49回 2025年1月27日開催:準備中
- 第50回 2025年2月17日開催:準備中
- 第51回 2025年3月17日開催:準備中
- 第52回 2025年4月28日開催:準備中
- 第53回 2025年5月26日開催:準備中
- 第54回 2025年6月23日予定
関連するリンク


