臨床研究センター【アニュアルレポート】
1.スタッフ(2024年4月1日現在)
| センター長 | 北山 丈二 | |
|---|---|---|
| 副センター長 | 神田 善伸、上武 久雄 | |
| アドバイザー | 山形 宗倫 | |
| 部長 | (TR研究推進部) | 相澤 健一 |
| (企画開発部) | 星出 聡 | |
| (臨床研究・治験推進部) | 坂東 政司 | |
| (管理部) | 上武 久雄 | |
| (データサイエンス部) | 興梠 貴英 | |
| (広報啓発・ネットワーク推進部) | 大口 昭英 | |
| (監査管理部) | 竹井 裕二 | |
| 副部長 | (TR推進部) | 寺谷 工 |
| (臨床研究・治験推進部) | 和田 妙子、若松 朋恵 | |
| (管理部) | 和田 妙子、若松 朋恵 | |
| (データサイエンス部) | 三重野牧子 | |
| (広報啓発・ネットワーク推進部) | 石川 鎮清 | |
| (監査管理部) | 小原 泉 | |
| 医師(非常勤1名含) | 14名 | |
| 教員 | 3名 | |
| 薬剤師 | 15名 | |
| 看護師 | 19名 | |
| 臨床検査技師 | 2名 | |
| 事務 | 13名 | |
2.臨床研究センターの特徴
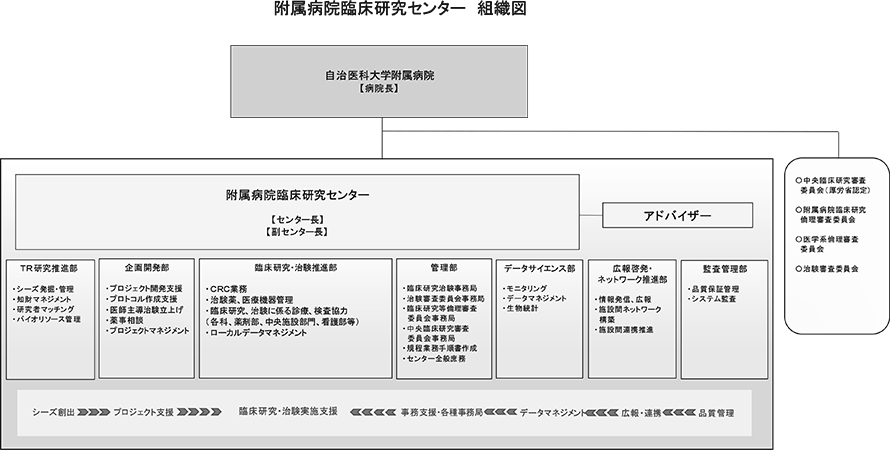
附属病院で行われる臨床研究や治験等が、高い倫理性及び科学的妥当性により、適切かつ円滑に実施されるよう、自治医科大学に設置していた臨床研究支援センターと附属病院臨床研究センターを統合し、2022年4月からは病院長の管轄のもと臨床研究センターにTR研究推進部、企画開発部、臨床研究・治験推進部、管理部、データサイエンス部、広報啓発・ネットワーク推進部、監査管理部の7つの部門が置かれ、医師、薬剤師、看護師及び事務職員を適切に配置し、橋渡し研究から臨床研究・治験まで、切れ目のない支援体制、円滑な実施体制を構築している。
また、この7つの部門間の部門連絡会議を定期的に開催し、円滑な運営、情報共有等に努め、各種専門家が協力して、臨床研究及び治験を推進することに努めている。(図1)
図1.附属病院臨床研究センター 組織図
3.実績及びクリニカルインディケーター
【臨床研究】
(1)2022年度までの実績
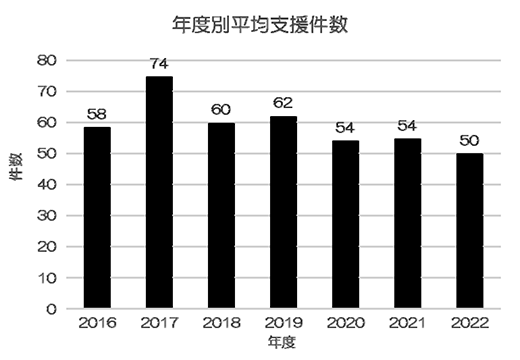
図2は年度別の臨床研究コーディネーター(以下、「CRC」)による支援件数の推移であり、平均して常に50件以上の研究を支援してきた。なお、臨床研究法の経過措置終了後の2019年度以降、臨床研究法に基づき行われた臨床試験の平均支援件数は31件で、全体の52%であった。
図2.年度別平均支援件数(研究)
【治験】
(1)治験実績
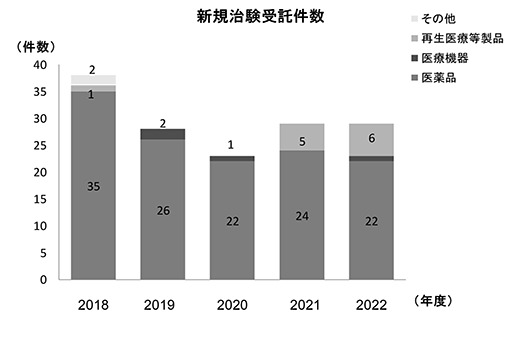
2018年度から2022年度までの治験の総実施件数、新規治験受託件数の年次推移を示す(図3、4)。また、5年間(2018年度~2022年度)の治験の平均新規受託件数は29.4件(79.0症例)、製造販売後調査は26.6件(88.0症例)であった。治験の新規受託件数は通年30件前後で推移しており、2022年度の実施率は71.6%であった。また、治験の中で国際共同治験が占める割合は2022年度では治験全体の53.9%を占めており、国際標準で難易度の高い治験を積極的に行っている。
図3.新規治験受託件数(治験)
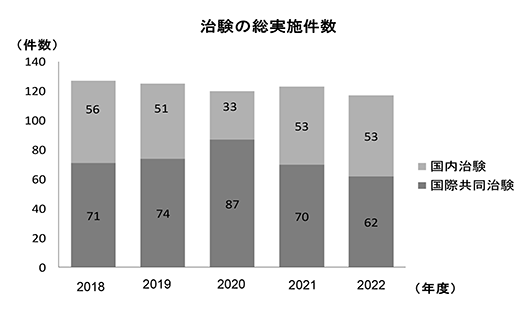
図4.治験の総実施件数(治験)
(2)医師主導治験の実施支援
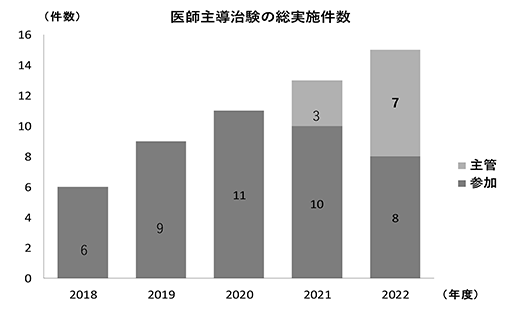
医師主導治験は企業主導治験と異なり治験に係わる業務を治験責任医師が全て行わなければならないため、その業務量は企業主導治験の十数倍にのぼる。そのためCRCが全面的支援を行わなければ実施困難となる難易度の高い治験である。当院では2006年に参加型医師主導治験の支援体制を整備し、支援を開始した。支援件数は年々増加しており、2021年度からは更に主管型医師主導治験を支援しており、2022年度の主管型医師主導治験は7件まで増加した(図5)。
図5.医師主導治験の総実施件数(治験)
(3)小児治験ネットワーク支援業務
2022年度は小児治験ネットワークを介した治験を1件受託した。
小児治験ネットワークを経由して治験の実施可能性を打診する調査は、2022年度では12件の可能性調査に協力している。また、CRC教育研修プログラムとして他医療機関より研修生を受入れ、2日間のCRC実施研修を行っているが、2022年度も中止になった。
(4)市民向けの治験啓発活動
市民に対する啓発活動の一環として毎年市民公開講座を行っているが、2022年度も新型コロナウイルス感染拡大を懸念し中止とした。
(5)薬学部学生に対する治験実習
当院で受入れている薬学部学生の病院実習期間約2ヶ月半のうちの2日間を当部門で担当している。2022年度は23名の薬学部学生の実習を受入れた。治験を行う意義、生命倫理等の講義をはじめ、CRC業務経験(患者の対応)や治験薬の管理等を通して治験の重要性を認識して貰った。
4.研究業績
【臨床研究】
(1)学会発表等
該当なし
【治験】
(1)小児医薬品開発ネットワーク支援業務
日本小児科学会が国立成育医療研究センターに委託している小児医薬品開発ネットワーク支援事業として、製薬企業から提出された開発計画を検討するワーキンググループが発足し、当部門スタッフがその一員として参加している。
(2)学会発表
該当なし
5.2024年の目標・事業計画等
【臨床研究】
(1)本学主管の特定臨床研究の積極的な支援
本学主管の多機関共同研究が本格的に開始し、本学や外部支援機関のみならず多くの医療機関と密に連携し、代表機関及び実施施設としての両役割を遂行できている。引き続き、代表医師をサポートし、特定臨床研究の品質を担保するため、本研究の終了までマネジメント業務を継続する。
(2)学会発表等
臨床研究法の施行後、臨床研究におけるコーディネーター業務の難しさは、学会等でも取り上げられている。当院における具体的な支援内容を、学会等を通じて外部に発信していくことで、臨床研究推進の一助となるよう努める。
(3)研修会等への参加
「人を対象とする生命科学・医学系研究に関する倫理指針(令和3年文部科学省・厚生労働省・経済産業省告示第1号。)」は、個人情報保護法の改正に伴い、2022年及び2023年に一部改正が行われた。2024年度もガイダンスの改訂が予定されている。また、臨床研究法についても、2022年に一部改正が行われ、2024年も改正が予定されている。これらに関する研修会等には積極的に参加し、迅速に対応できるよう準備する。
【治験】
(1)新規治験積極的受入・治験実績アップ
診療科の間で治験受け入れにばらつきがある。治験の受託実績が少ない診療科には引き続き新規治験の受け入れを要請していく。
2022年度の患者の治験組入率は71.6%となり、厚労省が目標としている80%を下回っている。引き続き治験実施に関連する治験責任・分担医師の負担を軽減し、患者の組み入れがし易くなるような環境を整え、支援体制を強化していく。
(2)小児治験ネットワーク関連の小児治験活性化
小児科領域では小児適応のない医薬品を使用することも少なくなく、その適応外使用が社会的問題にもなっている。小児治験ネットワークは小児科領域のこれら課題解消に向けて活動しているが、当院も本ネットワークに参加して引き続き積極的な活動を行う。
(3)地域住民の治験に対する意識変化
引き続き市民公開講座『薬が誕生するまでを知りたくありませんか?』を開催する予定である。
日程等は現時点では未定となっている。
(4)当部門スタッフによる治験業務関連研究推進
引き続き治験業務に関連した研究を積極的に行い、学会発表・論文投稿につなげていく。
